Las aminas de bajo peso molecular son gases a temperatura ambiente.las mas pesadas y complejas son liquidos o solidos.
las aminas presentan puntos de ebullicion elevados debido a que las moleculas formas puentes de hidrogeno.
las aminas que tienen menos de seis carbonos son solubles en agua porque forman puentes de higrogeno con ella. aminas de mas de seis carbonos son insolubles en agua y solo se disuelven en solventes organicos.
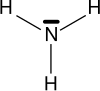
Como el amoniaco, las aminas son compuestos polares y pueden formar puentes de hidrógeno intermoleculares, salvo las terciarias. Las aminas tienen puntos de ebullición más alto que los compuestos no polares de igual peso molecular, pero inferiores a los de alcoholes o ácidos carboxílicos.

PROPIEDADES QUIMICAS
PROPIEDADES QUIMICAS
Las aminas son compuestos organicos derivados del amoniaco (NH3), y son producto de la sustitucion de los hidrogenos que componen al amoniaco por grupos alquilo o arilo.
Las aminas se clasifican de acuerdo al numero de sustituyentes unidos al nitrogeno en aminas primarias, aminas secundarias y terciarias.
Las aminas se clasifican de acuerdo al numero de sustituyentes unidos al nitrogeno en aminas primarias, aminas secundarias y terciarias.
Las aminas se obtienen tratando derivados halogenados o alcoholes con amoniaco.
Produccion de aminas a partir de derivados halogenados
Reacciones para reconocer aminas en el laboratorio:
Para diferenciar las aminas entre si en el laboratorio se hacen reaccionar con una solucion de nitrito de sodio y acido clorhidrico, esto da origen a acido nitroso inestable. Cada tipo de amina tendra un comportamiento diferente frente al acido nitroso, dependiendo ademas de la temperatura a la cual se lleve a cabo la reaccion.
Produccion de aminas a partir de derivados halogenados
Reacciones para reconocer aminas en el laboratorio:
Para diferenciar las aminas entre si en el laboratorio se hacen reaccionar con una solucion de nitrito de sodio y acido clorhidrico, esto da origen a acido nitroso inestable. Cada tipo de amina tendra un comportamiento diferente frente al acido nitroso, dependiendo ademas de la temperatura a la cual se lleve a cabo la reaccion.